肉の手帖
動物用医薬品等の基礎知識やルールまとめ。
動物用医薬品等とは、人間でいう医療用医薬品や医薬部外品などのことです。動物も人間と同じく病気にかかることがあるため、その治療や予防で薬を使用することがあります。
人間の薬ではないため、一見すると私たちには関係ないものだと思うかもしれません。ですが、動物用医薬品によって生まれた薬剤耐性菌が、お肉を食べたり畜産動物と触れ合ったりするなかで、人間に感染する可能性もあります。そのため、必ずしも無縁とは言い切れません。
今回は動物用医薬品等、特に動物用医薬品のルールについて見ていきたいと思います。
なお、先に本記事をご覧いただくにあたっての注意事項を3点、お伝えしておきます。
1:本記事中には「第1条・第1項」のように、条項名だけ記載された箇所がありますが、特に法律名の明記がない場合、これらはすべて「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(以下、医薬品医療機器等法)のものです。
2:本記事には「医薬品」「動物用医薬品」の2つの単語が出てきます。前者は人にも動物にも使用される一方、後者は動物にしか使用されないという違いがあるので、混同しないようにお気をつけください。
3:医薬品医療機器等法は基本的に人用の医薬品等に関する規定ですが、第83条・第1項に記載された読み替えのルール(厚生労働大臣を農林水産大臣と読み替える、など)を適用することで、動物用医薬品等の規定となります。
そもそも動物用医薬品等とは
動物用医薬品等とは、冒頭にもあるとおり、人間でいう医療用医薬品や医薬部外品、医療機器などの動物版です。厳密には、医薬品医療機器等法で次のように定義されています。
| カテゴリ | 定義 | 条項 | |
|---|---|---|---|
| 動物用医薬品 | 右の目的で使用される機械器具類でないもの | (1)疾病の診断・治療・予防 (2)動物の身体の構造または機能に影響を及ぼすこと |
第2条 第1項 |
| 動物用医薬部外品 | 右の目的で使用される機械器具等でないもので、人に対する作用が緩和なもの | (1)吐きけその他の不快感又は口臭若しくは体臭の防止 (2)あせも、ただれ等の防止 (3)脱毛の防止、育毛又は除毛 (4)ねずみ、はえ、蚊、のみなどの防除 (5)動物用医薬品と同じ目的で使用される、農林水産省に指定されたもの |
第2条 第2項 |
| 動物用医療機器 | 右の目的で使用される機械器具等であるもの | (1)疾病の診断・治療・予防 (2)動物の身体の構造または機能に影響を及ぼすこと |
第2条 第4項 |
(ほかに動物用再生医療等製品などもありますが、ここでは割愛します)
このうち動物用医薬品の用途は、上にもあるとおり次の3つです。
・疾病の診断(診断薬)
・疾病の治療(治療薬)
・疾病の予防(予防薬)
診断薬には、牛の白血病を調べる検査キットなどがあります。正式には「体外診断用医薬品」と呼ばれ、ほかの動物用医薬品などとは少し違ったルールが定められています。
治療薬には、抗生物質や合成抗菌剤、麻酔薬や解熱剤、鎮痛剤などがあります。予防薬は病気になるまえに使う医薬品で、ワクチンなどです。
動物用医薬部外品には、虫よけ用のスプレーやシャンプー、蚊取り線香をはじめとする駆虫剤などが含まれます。
ただし、これらのカテゴリーをまたぐものもあるので注意が必要です。たとえば動物用シャンプーには、動物用医薬品のもの、動物用医薬部外品のもの、それ以外のものと3種類あります。
化粧品について
医薬品医療機器等法では、ほかに「化粧品」というカテゴリも規定されています。ですが、これは人が使う医薬品等にのみあてはまる分類で、動物用医薬品等では存在しません。
たとえば、シャンプーの場合、人が使うものは「医薬品・医薬部外品・化粧品」の3種類に分類されますが、動物用シャンプーの場合は「動物用医薬品・動物用医薬部外品・それ以外」の3種類です。そのため、医薬品医療機器等法の化粧品に関する規定は、動物用シャンプーの場合にはあてはまりません(※1)
動物用医薬品のルールは、動物の種類によって変わる
動物用医薬品等には、使用できる動物が制限されているものと、そうでないものがあります。
たとえば医薬品等の承認可否について定めた規定、第14条・第2項・第3号のロと、第83条・第1項には、次のようにあります。
申請に係る医薬品若しくは医薬部外品が、その効能若しくは効果に比して著しく有害な作用を有することにより、医薬品若しくは医薬部外品として使用価値がないと認められるとき、又は申請に係る医薬品が、その申請に係る使用方法に従い使用される場合に、当該医薬品が有する対象動物(牛、豚その他の食用に供される動物として農林水産省令で定めるものをいう。以下同じ。)についての残留性(医薬品の使用に伴いその医薬品の成分である物質(その物質が化学的に変化して生成した物質を含む。)が動物に残留する性質をいう。以下同じ。)の程度からみて、その使用に係る対象動物の肉、乳その他の食用に供される生産物で人の健康を損なうものが生産されるおそれがあることにより、医薬品として使用価値がないと認められるとき
(医薬品医療機器等法 第14条 第2項 第3号のロ、第83条 第1項より。太字は引用者による)
太字にしてあるところをご覧いただくと、規制の対象となる動物は、
・牛
・豚
・その他の食用に供される動物として農林水産省令で定めるもの
です。動物用医薬品等の種類によっては、これらの動物にしか使用できないものがあります。
このうち3番目の「農林水産省令で定めるもの」とは、動物用医薬品等取締規則・第24条によって規定された次の動物たちです。
・牛
・馬
・豚
・鶏
・うずら
・蜜蜂
・食用に供するために養殖されている水産動物
基本的には、牛用の動物用医薬品等を、豚など他の動物に使用してはいけません。ただし、獣医師がやむを得ないと判断した場合には、使用対象の動物以外への薬の使用が認められています(※2)。そのため、ヒト用の医薬品が牛や豚に使用されることもあります。
なおこの場合は、獣医師が使用量や休薬期間を見極めて使用します。それ以外の方が使用してはいけません。また獣医師であっても、以下の成分を有効物質とする動物用医薬品等は、残留毒性が否定できないため使用が禁止されています。
イプロニダゾール、オラキンドックス、カルバドックス、クマホス、クロラムフェニコール、クロルスロン、クロルプロマジン、ジエチルスチルベストロール、ジメトリダゾール、ニトロフラゾン、ニトロフラントイン、フラゾリドン、フラルタドン、マラカイトグリーン、メトロニダゾール、ロニダゾール(※3)
また物によっては、使用量や方法、使用禁止期間も規定されています。
具体的に知りたい方は「動物用医薬品及び医薬品の使用の規制に関する省令」の別表第1から第4をご覧ください。
動物用医薬品は、認可された業者しか製造販売できない
ここからは動物用医薬品等の具体的なルールを見ていきます。医薬品医療機器等法では、製造や販売、輸入や表示、使用など幅広い事柄について規定されていますが、ここでは皆さんの日常生活と関係が深い内容のみを取り上げて説明します。
製造には許可が必要である
動物用医薬品、動物用医薬部外品の製造には、(1)製造業者としての許可(製造業の許可)と、(2)各医薬品等の製造認可(医薬品、医薬部外品及び化粧品の製造販売の承認)という、大きく2つの認可が必要です。
1.「製造業の認可」について
これは医薬品医療機器等法の第13条・第1項で定義されています。
医薬品、医薬部外品又は化粧品の製造業の許可を受けた者でなければ、それぞれ、業として、医薬品、医薬部外品又は化粧品の製造をしてはならない。
(医薬品医療機器等法 第13条 第1項)
この許可は農林水産省によって製造施設ごとに与えられます。つまり、ある企業が5つの工場で動物用医薬品等の製造を行いたい場合、工場ごとに許可を得なければなりません。
また製造する動物用医薬品等の種類によって、次のように必要となる許可が変わってきます。
*動物用医薬品と動物用医薬部外品の場合
(医薬品医療機器等法 第12条 第1項)
| 製造するもの | 必要な許可 |
|---|---|
| 処方箋医薬品(要指示医薬品) | 第一種医薬品製造販売業許可 |
| それ以外の医薬品 | 第二種医薬品製造販売業許可 |
| 医薬部外品 | 医薬部外品製造販売業許可 |
*動物用医療機器と動物用体外診断用医薬品の場合
(医薬品医療機器等法 第23条の2 第1項)
| 製造するもの | 必要な許可 |
|---|---|
| 高度管理医療機器 | 第一種医療機器製造販売業許可 |
| 管理医療機器 | 第二種医療機器製造販売業許可 |
| 一般医療機器 | 第三種医療機器製造販売業許可 |
| 体外診断用医薬品 | 体外診断用医薬品製造販売業許可 |
さらに、動物用医薬品は国内だけで製造されていません。海外の業者が製造して日本へ輸出されるものもあります。この場合、その業者は医薬品等外国製造業者の認定を受けなければなりません(第13条の3 第1項)
2.「医薬品、医薬部外品及び化粧品の製造販売の承認」について
次に製造する医薬品等ごとに与えられる許可についてです。これは、第14条・第1項で規定されています。
医薬品(厚生労働大臣が基準を定めて指定する医薬品を除く。)、医薬部外品(厚生労働大臣が基準を定めて指定する医薬部外品を除く。)又は厚生労働大臣の指定する成分を含有する化粧品の製造販売をしようとする者は、品目ごとにその製造販売についての厚生労働大臣の承認を受けなければならない。
(医薬品医療機器等法 第14条 第1項)
引用は原文のままですが、冒頭に示した第83条・第1項の規定に則って「厚生労働大臣」は「農林水産大臣」に置き換える必要があります。
動物用医薬品・動物用医薬部外品は原則、農林水産省、厚生労働省、食品安全委員会によるチェックを通過して、承認を与えられてはじめて製造・販売できるようになります。
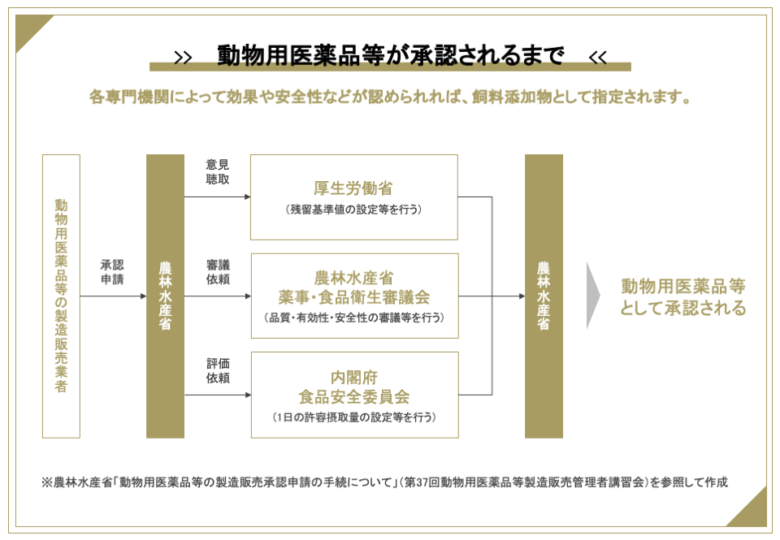
承認は次のようなフローで進みます。
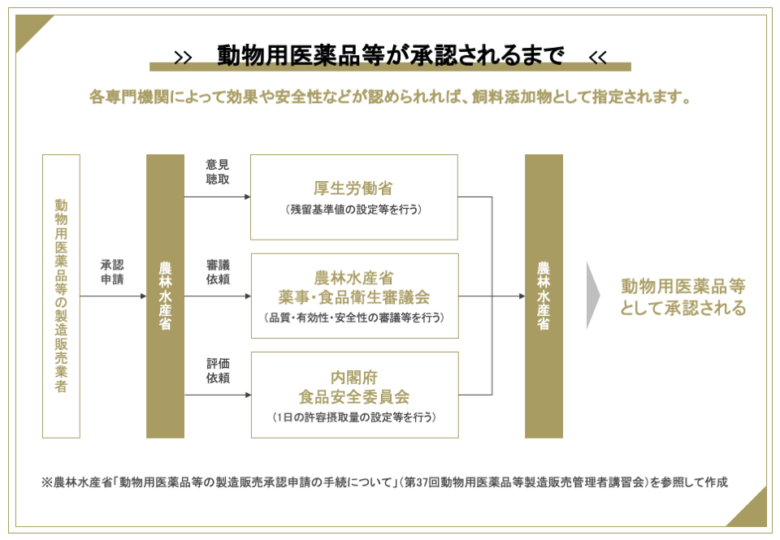
このとき動物用医薬品については、各機関が以下の基準を設定します。
・農林水産省:用法、用量、休薬期間
・厚生労働省:残留基準値(MRL)
・食品安全委員会:1日の許容摂取量(ADI)
この点については後ほど詳述します。
製造販売の承認の有無は、動物用医薬品等データベースで誰でも調べられる
こうして晴れて承認された動物用医薬品等が製造・販売されるわけですが、実はこの許認可の有無は皆さんも「動物用医薬品等データベース」(提供・農林水産省)というサイトから調べることができます。
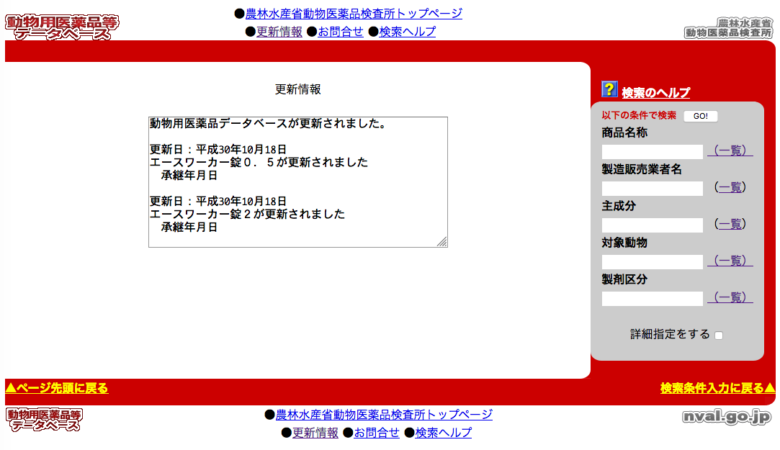
(引用:動物用医薬品等データベース)
使い方としては、画像右のいずれかに情報を入れて「GO!」のボタンをクリックして検索します(商品名に含まれるカギ括弧を抜いただけで検索にかからなくなるなど、使い勝手に少し癖があるのでご注意ください)
ダイメトンで検索してみた結果が下の画像です。
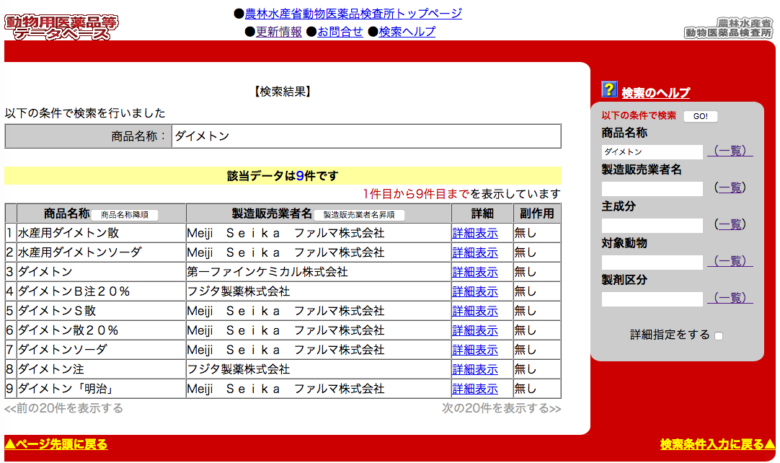
(引用:動物用医薬品等データベース)
画像のなかにある「詳細表示」をクリックすると、承認年月日や対象動物、効能や用法、使用上の注意や使用禁止期間、副作用などの情報が記載された資料を閲覧できます。
このデータベースで検索して出てこなかった動物用医薬品等は、農林水産省の許可が降りていないことになります。そのためこちらに登録がない動物用医薬品等は原則、使用できません。ただし前述のとおり、獣医師が必要と判断した場合には、使用が認められています。
GMPガイドラインについて
最後に、製造に関してもうひとつ重要なルールがあります。それがGMPガイドラインです。動物用医薬品を製造する業者は、GMPガイドラインを遵守しなければなりません。
これは1994年に発令された「動物用医薬品の製造管理及び品質管理に関する省令」で定められているルールで、通称「GMP省令」とも呼ばれます。
動物用医薬品等の使用法には、4つのルールがある
認可が降りた動物用医薬品等は、無事に製造・販売され、使用されます。
使用に際しては、以下の4つのルールを遵守しなければなりません。
| ルール | 該当条項 | 対象となる医薬品等の種類 |
|---|---|---|
| 要指示医薬品制度 | 第49条 | 動物用医薬品、動物用医薬部外品、動物用医療機器 |
| 未承認医薬品規制制度 | 第14条 | 動物用医薬品、動物用医薬部外品 |
| 使用規制制度 | 第83条の4および5、動物用医薬品及び医薬品の使用の規制に関する省令 | 動物用医薬品 |
| 要診察医薬品制度 | 獣医師法 第18条 | 動物用医薬品 |
(※対象となる医薬品等の種類は、動物用医薬品、動物用医薬部外品、動物用医療機器の3つのみ分類)
要指示医薬品制度とは、処方せんが必要な医薬品に関する決まりです。
動物用医薬品等には処方せんが必要なものとそうでないものがあり、第49条は前者について「獣医師から処方せんを受け取った人以外に要指示医薬品を販売してはならない」と定めています。記事執筆段階では、動物用医薬品等取締規則の第168条および別表第3で、132種類の要指示医薬品が指定されています(※4)
未承認医薬品制度とは、農林水産省の承認を受けていない医薬品・医薬部外品に関する決まりです。先にも書きましたが、承認を得ていない動物用医薬品等は、製造・販売してはいけません。
使用規制制度については、第83条の4「動物用医薬品及び動物用再生医療等製品の使用の規制」の第1項に、次のように書かれています。
農林水産大臣は、動物用医薬品又は動物用再生医療等製品であつて、適正に使用されるのでなければ対象動物の肉、乳その他の食用に供される生産物で人の健康を損なうおそれのあるものが生産されるおそれのあるものについて、薬事・食品衛生審議会の意見を聴いて、農林水産省令で、その動物用医薬品又は動物用再生医療等製品を使用することができる対象動物、対象動物に使用する場合における使用の時期その他の事項に関し使用者が遵守すべき基準を定めることができる。
(医薬品医療機器等法 第83条の4 第1項)
ここにある農林水産省令で定める基準とは、先にも紹介した「動物用医薬品及び医薬品の使用の規制に関する省令」のことです。同省令には、各医薬品のADIや使用できる動物、休薬期間についてのルール(第2条および別表第2〜4)や、使用状況を帳簿にまとめなさいというルール(第4条)、特定の医薬品を使用できる動物(第6条)などが定められています(※5)
要診察医薬品制度については、獣医師法の第18条で次のように定められています。
獣医師は、自ら診察しないで診断書を交付し、若しくは劇毒薬、生物学的製剤その他農林水産省令で定める医薬品の投与若しくは処方若しくは再生医療等製品(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和三十五年法律第百四十五号)第二条第九項に規定する再生医療等製品をいい、農林水産省令で定めるものに限る。第二十九条第二号において同じ。)の使用若しくは処方をし、自ら出産に立ち会わないで出生証明書若しくは死産証明書を交付し、又は自ら検案しないで検案書を交付してはならない。ただし、診療中死亡した場合に交付する死亡診断書については、この限りでない。
(獣医師法 第18条より。太字は引用者による)
ここの冒頭にある農林水産省令で定める医薬品については、獣医師法施行規則の第10条の5で次のように規定されています。
一 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和三十五年法律第百四十五号)第四十九条第一項(同法第八十三条第一項の規定により読み替えて適用する場合を含む。)の規定に基づき厚生労働大臣又は農林水産大臣が指定した医薬品
二 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第八十三条の四第一項又は第八十三条の五第一項の規定に基づき農林水産大臣が使用者が遵守すべき基準を定めた医薬品
第1号は、要指示医薬品(処方箋医薬品)を指します。
第2号は、適正に使用されなければ生産物(お肉など)を口にした人の健康を害する恐れがある(動物用)医薬品を意味します。具体的には、第83条の4・第1項で規定された医薬品とは、先に示したADIや対象動物などの規定された動物用医薬品、第83条の5・第1項で規定された医薬品とは、同様の危惧がある動物用以外の医薬品および再生医療等製品です。
特に重要なADIや休薬期間についてはこのあと詳述しますが、それ以外はここでは割愛します。気になる方はぜひそれぞれの箇所で示した条文を読んでみてください。
動物用医薬品は、食品ごとの残留基準値やヒトの1日の許容摂取量が決められている
動物用医薬品等の承認のところで、残留基準値(MRL)と1日の許容摂取量(ADI)の話をしました。
これは厳密には動物用医薬品と動物用再生医療等製品のみに限られる話です。この2つには必ず出荷前の休薬期間や使用禁止期間、また食品ごとのMRLやADIといった基準が定められています。
それぞれの基準は、以下の機関が設定します。
| 基準項目 | 設定機関 | 条項 |
|---|---|---|
| 用法・用量・効能・副作用・休薬期間など | 農林水産省 | 第14条 |
| MRL | 厚生労働省 | 第83条 第2項 食品衛生法 第11条 |
| ADI | 食品安全委員会 | 食品安全基本法 第24条・第1項および同項・第8号(※6) |
休薬期間と使用禁止期間は、どちらも薬を与えてはいけない期間です。
MRL(Maximum Residue Limit:残留基準値)とは、生産物(お肉など)に残留していても、人の健康に影響を及ぼさない限界濃度です。特定の動物用医薬品等は、食品ごとにこのMRLが設定されています。
ADI(Acceptable Daily Intake:1日の許容摂取量)は、人が生涯にわたって食べつづけても健康上問題ない1日の許容量を意味します。
ADIについては先にふれたので、ここではMRLについて詳しくお伝えします。
肉やミルクにおいて、MRLが設定されている(ポジティブリスト制度と3種類の基準)
MRLについて理解する上で大切なのは、ポジティブリスト制度という考え方です。
ポジティブリスト制度とは、簡単にいえば「このリストに載っている動物用医薬品は、基準の範囲内で使っていいよ。それ以外は全部ダメだよ」という仕組みです。ちなみに対義語であるネガティブリスト制度は「このリストに載っている動物用医薬品は使っちゃダメだよ。それ以外はいいよ」という仕組みです。
日本は動物用医薬品に関して、2006年からポジティブリスト制度の運用を開始しました。この詳細は食品衛生法の第11条・第3項で次のように規定されています(少し長いですが、全文引用します)
農薬(農薬取締法(昭和二十三年法律第八十二号)第一条の二第一項に規定する農薬をいう。次条において同じ。)、飼料の安全性の確保及び品質の改善に関する法律(昭和二十八年法律第三十五号)第二条第三項の規定に基づく農林水産省令で定める用途に供することを目的として飼料(同条第二項に規定する飼料をいう。)に添加、混和、浸潤その他の方法によつて用いられる物及び医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第二条第一項に規定する医薬品であつて動物のために使用されることが目的とされているものの成分である物質(その物質が化学的に変化して生成した物質を含み、人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質を除く。)が、人の健康を損なうおそれのない量として厚生労働大臣が薬事・食品衛生審議会の意見を聴いて定める量を超えて残留する食品は、これを販売の用に供するために製造し、輸入し、加工し、使用し、調理し、保存し、又は販売してはならない。ただし、当該物質の当該食品に残留する量の限度について第一項の食品の成分に係る規格が定められている場合については、この限りでない。
(食品衛生法 第11条 第3項)
ここに書いてあるのは、ざっくりいえば「許可された動物用医薬品を、厚生労働大臣が定めたMRLを超えない限りにおいて使用していいよ」ということです。
引用箇所に書いてあるのは、「お肉やミルクに設定されたMRLを超えない限り、動物用医薬品等を使用していいよ」ということです。
なお、ここでいう「超えない限り」とは、「製品中の残留値が基準を超えない限り」という意味です。薬を投与した直後の牛からしぼったミルクがMRLを超えていたとしても、休薬期間を経た後にしぼったミルクならMRLを下回るので、通常通り出荷できます。
この条項から動物用医薬品の残留基準に関係する部分だけを整理すると、次のようになります。
| 条項の該当部分 | 対象となる動物用医薬品 | |
|---|---|---|
| 1 | 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 | ポジティブリスト対象外の動物用医薬品 |
| 2 | 人の健康を損なうおそれのない量として厚生労働大臣が薬事・食品衛生審議会の意見を聴いて定める量 | 残留基準値(一律基準)が設定された動物用医薬品 |
| 3 | 当該物質の当該食品に残留する量の限度について第一項の食品の成分に係る規格 | 残留基準値(暫定基準および本基準)が設定された動物用医薬品 |
上から順番に見ていきましょう。
ポジティブリスト対象外の動物用医薬品について
ここに該当する物質は安全性が確認されているため、ポジティブリスト制度において使用が認められています。そのため残留基準は存在しません。
この対象外物質は、2005年の厚生労働省告示第498号によって指定され、2015年11月11日の最終改正時点で70種類の物質(動物用医薬品以外も含む)がリストアップされています(※7)
一律基準が設定された動物用医薬品について
上記の表からMRLには2種類あることがわかります。一般的に表の2番目が「一律基準」、3番目が「残留基準」と呼ばれて区別されます。
このうち一律基準とは、対象となる動物用医薬品について一律で定められた基準です。食品衛生法の第11条に則って残留基準が定められた動物用医薬品、そしてそもそもポジティブリストから除外されている動物用医薬品以外は、この一律基準の適用対象となります。
一律基準には、国際的な調査データや各国の一律基準などを踏まえて、人の健康に問題ない量として0.01ppmという値が設定されています(※8)
動物用医薬品の残留基準の調べ方について
特定の動物用医薬品に個別で設定されたMRL(上の表における3の残留基準)は、以下のサイトで動物用医薬品ごとに調べることができます。
・残留農薬基準値検索システム
http://db.ffcr.or.jp/front/
また世界保健機構(WHO)と国連食糧農業機関(FAO)が共同で作成している食品などの国際標準規格であるCODEX(コーデックス)も、動物用医薬品の残留基準について定めています。こちらは以下のサイトから確認可能です。
・Index of Veterinary Drugs|CODEXALIMENTARIUS FAO-WHO
http://www.fao.org/fao-who-codexalimentarius/codex-texts/dbs/vetdrugs/veterinary-drugs/en/
(※リンクが切れている場合、CODEXのサイトへ行ったあと、サイト内検索で「Veterinary drug(動物用医薬品)」あるいは「MRLs」などをあててみてください)
また「MAXIMUM RESIDUE LIMITS (MRLs) AND RISK MANAGEMENT RECOMMENDATIONS (RMRs) FOR RESIDUES OF VETERINARY DRUGS IN FOODS」という資料をご覧いただくと、MRLsとADIが両方とも載っているので便利です。
さらに、皆さんの多くが気にされると思われるアメリカの動物用医薬品の残留基準については、連邦規則集に記載があります。
・eCFR|Code of Federal Regulations
https://gov.ecfr.io/cgi-bin/ECFR

(引用:連邦規則集Code of Federal Regulations)
上の画像の下部にあるリストメニューから「Title 21 – Food and Drugs」を選んでいただき、その先の画面で「Browse Parts」の500-599をクリックしていただくと、そこに「TOLERANCES FOR RESIDUES OF NEW ANIMAL DRUGS IN FOOD」というリンクがあると思います。そちらに動物用医薬品の残留基準が記載されています。
試しにこの3つで、アルベンダゾール(Albendazole)という医薬品について調べてみた結果の一部を、以下に載せておきます(単位:ppm。記事執筆時点)
| 日本 | アメリカ | CODEX | |
|---|---|---|---|
| 牛の肝臓 | 1 | 0.2 | 5 |
| 牛の筋肉 | 0.02 | 0.05 | 0.1 |
日本もアメリカも、肝臓と筋肉については国際的に安全とされるCODEXの基準を下回っていることがわかります。より詳しく知りたい方は、いろいろな動物用医薬品について、ぜひご自身で調べてみてください。
動物用医薬品を使いすぎると、人が薬剤耐性菌に感染するリスクが高まる
ここで薬剤耐性菌について少しふれておきたいと思います。
動物用医薬品は牛をはじめとする畜産動物の健やかな成長に欠かせないものですが、使いすぎると薬剤耐性菌を生み出すというリスクがあります。それが抗菌性物質と呼ばれる種類の動物用医薬品です。
薬剤耐性菌とは、簡単にいえば薬が効きにくくなった菌のことです。
抗菌性物質とは、なんらかの菌を静菌(増殖を抑える)あるいは殺菌(死滅させることで数を減らす)する作用を持つ物質で、抗生物質などが該当します。
細菌は抗菌性物質の作用にさらされると、生き残るために必死に抵抗します。これによって耐性を獲得した菌は、それまで効いたはずの抗菌性物質が効かなくなります=死滅しなくなります。
こうなると菌は畜産動物の体内に残りつづけます。そして、その生産物を口にした人に感染する恐れがあるのです(なお、ワクチンをたくさん使えば抗菌性物質を使う回数が減り、耐性菌のリスクも減ります)
こうした薬剤耐性菌を生み出さないために、政府は動物用医薬品が適正に使用されるよう、厳格なルールを定めたり(先に紹介した使用に関する4つのルールなどです)、食品安全委員会によるリスク評価などを実施したりしています。
詳細は以下に詳しいので、ぜひご覧になってみてください。
・家畜に使用する抗菌性物質について|厚生労働省
http://www.maff.go.jp/j/syouan/tikusui/yakuzi/koukinzai.html
・かしこく治して、明日につなぐ ~抗菌薬を上手に使って薬剤耐性(AMR)対策~|厚生労働省
http://amr.ncgm.go.jp/
最後に:規定内容と該当条項のまとめ
動物用医薬品等については以上となります。多くの法律や規則が登場したのでわかりにくい部分もあったかもしれません。ですが、皆さんの健康にも関係してくる話ですので、少しずつでも興味を持っていただければと思います。
医薬品医療機器等法の第1条の6には、「国民の役割」と題して次のようにあります。ぜひ覚えておいてください。
国民は、医薬品等を適正に使用するとともに、これらの有効性及び安全性に関する知識と理解を深めるよう努めなければならない。
最後に、今回参照した法律の条項とその内容を一覧にしておきます。読み返すときやご自身で調べ物をされるときの参考になれば幸いです。
| 動物用医薬品等について | 動物用医薬品の定義 | ・医薬品医療機器等法 第2条 第1項 |
|---|---|---|
| 動物用医薬部外品の定義 | ・医薬品医療機器等法 第2条 第2項 | |
| 動物用医療機器の定義 | ・医薬品医療機器等法 第2条 第4項 | |
| 対象動物について | 対象動物の定義 | ・医薬品医療機器等法 第14条 第2項 第3号のロ、第83条 第1項 ・動物用医薬品等取締規則 第24条 |
| 対象動物の決められた動物用医薬品の使用方法 | ・動物用医薬品及び医薬品の使用の規制に関する省令 別表第1〜第4 | |
| 動物用医薬品等の製造について | 製造許可について | ・医薬品医療機器等法 第13条 第1項 |
| 製造許可の種類について | ・医薬品医療機器等法 第12条 第1項、第23条の2 第1項 | |
| 海外での製造許可について | ・医薬品医療機器等法 第13条の3 第1項 | |
| 医薬品単位での製造許可について | ・医薬品医療機器等法 第14条 第1項 | |
| GMPガイドラインについて | ・動物用医薬品の製造管理及び品質管理に関する省令 | |
| 動物用医薬品の使用について | 要指示医薬品制度 | ・医薬品医療機器等法 第49条 |
| 要指示医薬品に指定された医薬品の一覧 | ・動物用医薬品等取締規則の第168条および別表第3 | |
| 未承認医薬品規制制度 | ・医薬品医療機器等法 第14条 | |
| 使用規制制度 | ・医薬品医療機器等法 第83条の4および5 ・動物用医薬品及び医薬品の使用の規制に関する省令 |
|
| 医薬品ごとのADIや対象動物、休薬期間について | ・動物用医薬品及び医薬品の使用の規制に関する省令 第2条および別表第2〜第4 | |
| 使用した医薬品をまとめる帳簿について | ・動物用医薬品及び医薬品の使用の規制に関する省令 第4条 | |
| 特定の医薬品の対象動物について | ・動物用医薬品及び医薬品の使用の規制に関する省令 第6条 | |
| 要診察医薬品制度 | ・獣医師法 第18条 ・獣医師法施行規則 第10条の5 |
|
| 動物用医薬品の使用について | MRLを定めなければならないとする規定 | ・医薬品医療機器等法 第83条 第2項 ・食品衛生法 第11条 |
| ADIを定めなければならないとする規定 | ・食品安全基本法 第24条 第1項および同項 第8号 | |
| ポジティブリスト制度に関する規定 | ・食品衛生法 第11条 第3項 | |
| ポジティブリスト制度の対象外物質について | ・厚生労働省告示第498号(2005年公布。最終改正2015年11月11日) |
参照
・※1:動物用医薬品等に該当するか否かの考え方|農林水産省
・※2:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律 第83条の4|e-Gov
・※3:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律に基づく医薬品及び再生医療等製品の使用の禁止に関する規定の適用を受けない場合を定める省令|e-Gov
・※4:動物用医薬品等取締規則|e-Gov
・※5:動物用医薬品及び医薬品の使用の規制に関する省令|e-Gov
・※6:動物用医薬品に関する食品健康影響評価指針|食品安全委員会
・※7:食品衛生法第11条第3項の規定により人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質(対象外物質)|厚生労働省
・※8:いわゆる一律基準についての質問 – ポジティブリスト制度について(Q&A)|厚生労働省







